急性髓系白血病(AML)作为最难治疗的一种白血病,具有起病急、进展快、复发率高等特点。AML的临床治疗以“7+3”疗法为主,但在应用中经常表现出较大的毒副作用和有限的治疗功效。因此,亟需开发新型治疗策略来实现对AML的安全高效治疗。小分子抑制剂具有高特异性,低脱靶毒性和显著的治疗效果等特点,在肿瘤治疗中受到越来越多的关注。
近日,老澳门开奖结果2024开奖记录邓超教授和钟志远教授团队构建了苯硼酸功能化的聚多肽纳米载体来有效共载和响应性释放BCL2(ABT199)和MCL1(TW37)小分子抑制剂,进而实现了对AML的协同高效治疗(图1)。相关成果以“Codelivery of BCL2 and MCL1 Inhibitors Enabled by Phenylboronic Acid-Functionalized Polypeptide Nanovehicles for Synergetic and Potent Therapy of Acute Myeloid Leukemia”为题发表在Advanced Science杂志上(DOI: 10.1002/advs.202204866)。
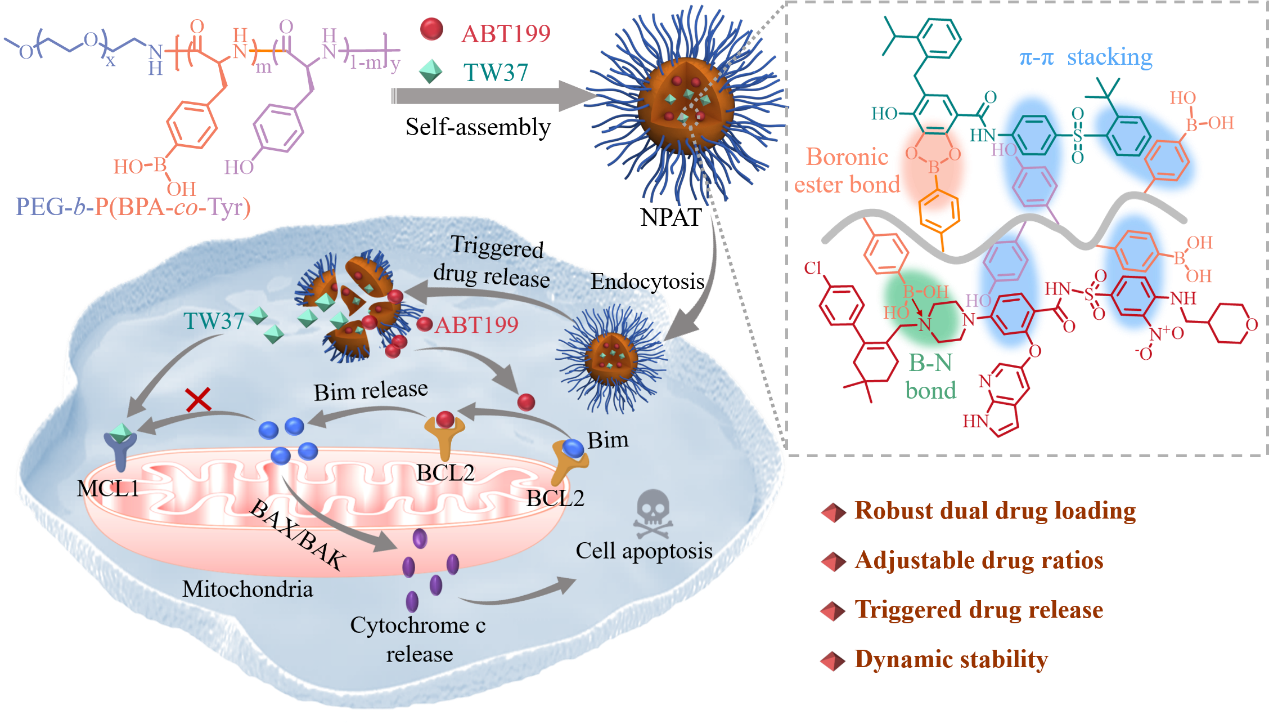
图1苯硼酸功能化的聚多肽纳米载体通过高效共载和触发释放BCL2和MCL1抑制剂来实现对AML的协同治疗
利用药物和聚多肽链段间形成的动态硼酸酯键、B-N配位以及π-π堆积作用制备的纳米药物(NPAT)具有较好的药物共包封能力以及稳定性。NPAT在药物理论载药量为10 ~ 25 wt.%时,TW37的载药效率超过88%,ABT199的载药效率更是超过97%。ABT199可以竞争结合BCL2,促使促凋亡蛋白Bim从BCL2上解离;TW37能通过下调MCL1阻碍释放的Bim与MCL1结合,NPAT在酸性/过氧化氢/酶的环境中能快速释放药物,对MOLM-13-Luc和MV-411白血病细胞表现出显著的协同毒性,协同指数CI约为0.35(图2)。
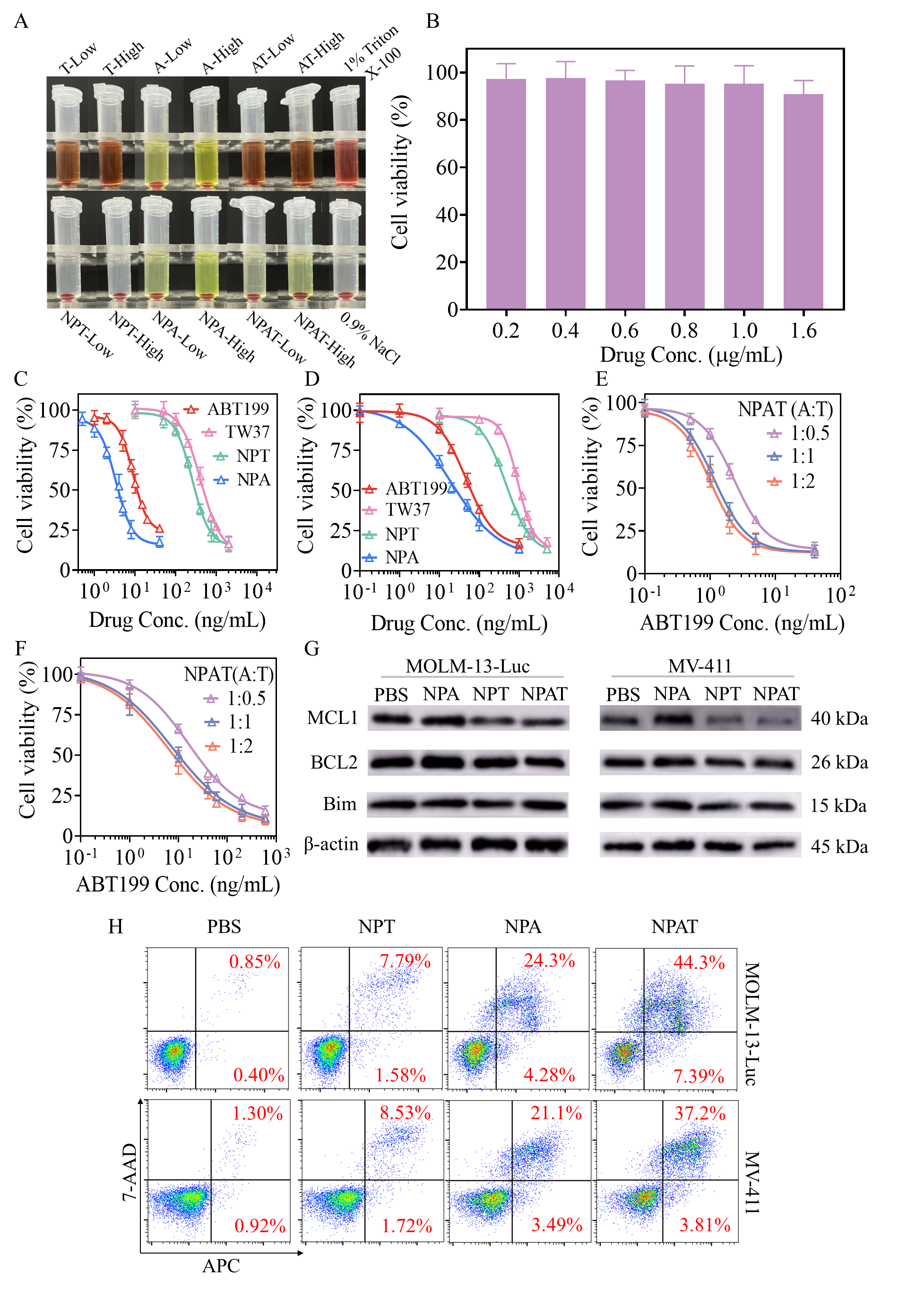
图2纳米药物NPAT的血液相容性和细胞毒性
在荷原位MOLM-13-Luc和MV-411小鼠模型中,NPAT显著抑制了白血病细胞在小鼠体内的增值,使白血病细胞在骨髓和其它重要器官中的浸润率分别小于0.4%和2%,同时显著提高小鼠存活率(图3)。该苯硼酸功能化的纳米药物具有结构简单、药物组合可调、安全性高、协同疗效强等特点,可方便推广到多种癌症的治疗中。

图3纳米药物NPAT对荷原位MOLM-13-Luc AML小鼠的体内治疗
苏州大学为该论文第一单位,研究生谢吉国和赵小飞为共同第一作者,新澳门今晚开奖直播现场邓超教授和钟志远教授为通讯作者。该工作得到国家重点研发计划(2021YFB3800900, 2022YFB3804600)和国家自然科学基金(基金号:51973149,51873144, 52073195)项目的资助。
论文链接:https://doi.org/10.1002/advs.202204866