放射医学与辐射防护国家重点实验室杨光保教授在乏氧响应载体构建及药物递送方面取得进展,相关成果在国际知名期刊Advanced Optical Materials(IF:10.05)上在线发表了题为“Light-Triggered Hypoxia-Responsive Nanoscale Metal-Organic Frameworks for Highly Efficient Antitumor Treatment”的研究论文。论文链接https://onlinelibrary.wiley.com/doi/full/10.1002/adom.202201043。
光动力治疗在杀伤肿瘤细胞的同时,大量氧气的消耗会在肿瘤部位导致缺氧。由此产生的乏氧环境可与其他对缺氧细胞有选择性杀伤作用的药物结合,以克服缺氧肿瘤的治疗耐药性。作为生物还原剂的抗肿瘤药-替拉扎明,对低氧肿瘤细胞具有高选择性的毒性,但不会对正常组织造成明显的副作用。此外,基于肿瘤微环境的响应性载体已广泛应用于肿瘤部位药物特异性递送,在外部(磁、热以及光等)或内部(pH、酶等)刺激下可控释放负载的药物。然而,基于光动力治疗产生的乏氧微环境促使递送载体解离并可控释放药物,实现光动力治疗诱导乏氧激活的化疗还有待进一步的研究。
纳米金属有机框架材料(NMOFs)广泛应用于药物递送,构建该类材料一种新兴策略是在框架中引入刺激响应的有机连接剂,从而在受到特殊刺激时结构发生显著变化,以释放其负载的药物。本研究中,利用乏氧响应的偶氮苯配体构建纳米金属有机框架材料(UiO-AZB),之后在颗粒表面修饰白蛋白连接的光敏剂二氢卟吩e6(Ce6)并负载乏氧激活抗肿瘤药物替拉扎明。该纳米颗粒在660 nm激光照射下,可通过光动力治疗有效地杀伤肿瘤细胞。在肿瘤内还原酶作用下,光动力治疗过程中消耗氧气所产生的乏氧微环境会使UiO-AZB结构中偶氮苯键断裂,促进该纳米颗粒解离并同时释放出已被激活的化疗药物替拉扎明用于对肿瘤细胞的进一步杀伤。因此,在该乏氧刺激响应的药物递送体系中,单次光照可触发多重响应:1)高效光动力治疗;2)促进纳米颗粒结构解离;3)激活生物还原性药物;4)可控释放被激活前药,通过单个刺激实现多重作用以提高肿瘤治疗疗效。
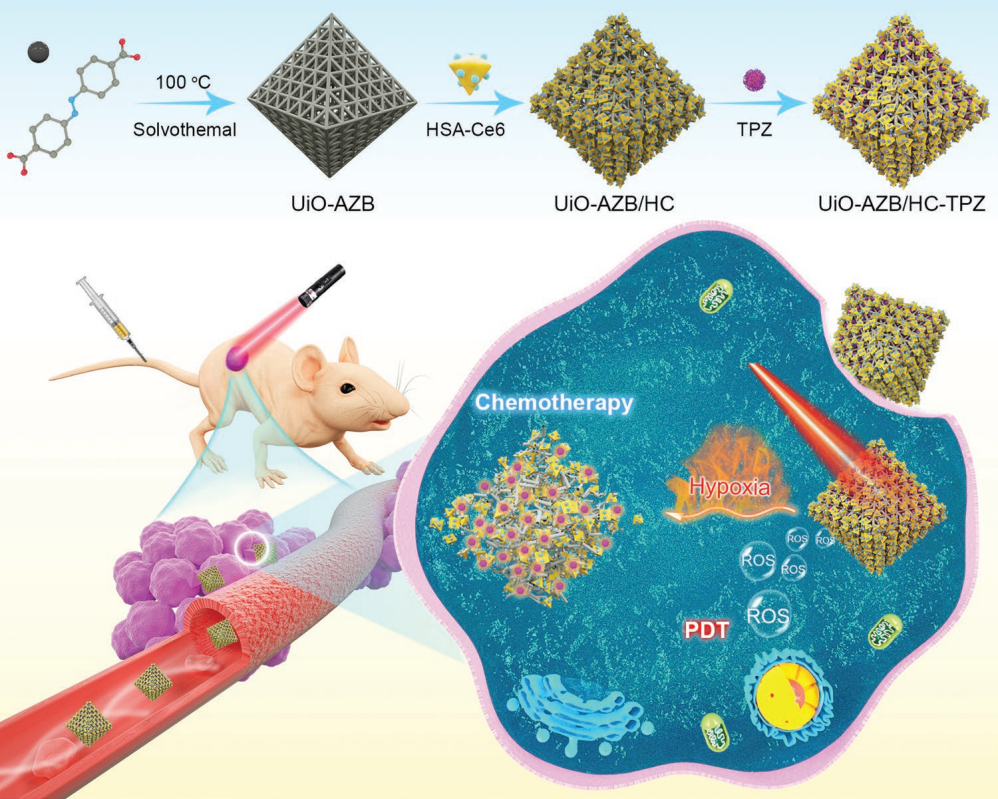
图1. 纳米治疗体系合成及光激活缺氧反应的肿瘤药物递送示意图。
本工作中,苏州大学为该论文第一单位。放射医学与辐射防护国家重点实验室杨光保教授为该论文第一作者,新加坡南洋理工大学赵彦利教授为本文通讯作者。该工作得到国家自然科学基金,新加坡国立研究基金等项目的共同资助。